APPLICAZIONI IN ODONTOIATRIA RIGENERATIVA
DU FIBRINA RICCA DI PLATELINE (PRF)
Tutte le tecniche di chirurgia orale possono essere combinate con la PRF: innesti ossei
innesti gengivali e impianti dentali
APPLICAZIONI IN ODONTOIATRIA RIGENERATIVA
DU PLATELETTE-RICH FIBRIN - PRF
La maggior parte dei trattamenti chirurgici esistenti in chirurgia orale sono stati modificati in linea con la tecnica PRF. Ma non solo: nuovi protocolli terapeutici in odontoiatria e medicina sono stati inventati grazie alla formidabile capacità rigenerativa degli FRP.
Tutti gli scienziati e i medici si sforzano di esplorare l’immenso potenziale di questa nuova terapia e di modificare gli atteggiamenti con la stessa rapidità dei protocolli.
Ad esempio, le tecniche chirurgiche per gli innesti gengivali e ossei sono state riformulate e reinventate in linea con i principi dell’odontoiatria rigenerativa, grazie al dottor Joseph Choukroun, il suo ideatore. Come i suoi predecessori, ha creato un intero mondo e una comunità medica che ruota intorno ai suoi principi, che ha enunciato e continua a enunciare.
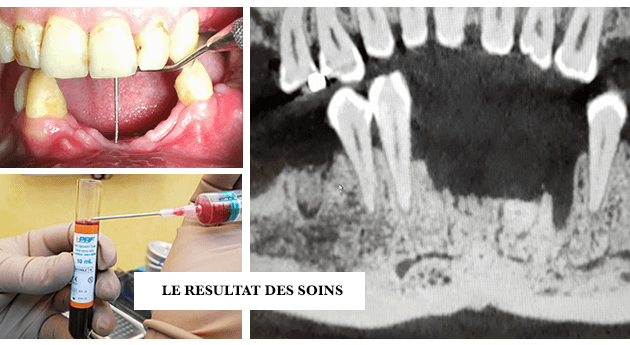
1. PRF PER LA GESTIONE DEGLI ALVEOLI A SEGUITO DI ESTRAZIONI DENTARIE
Nota: i protocolli per il riempimento degli alveoli dentali sono descritti in modo più specifico nel capitolo“Innesti ossei pre-implantari“.
Le proprietà di guarigione e i benefici dell’uso della fibrina ricca di piastrine (PRF) vengono utilizzati per ottimizzare la guarigione dell’osso nelle orbite vuote dopo l’estrazione del dente e ridurre la perdita ossea.
Recenti ricerche hanno dimostrato che la causa principale del riassorbimento tridimensionale accelerato dell’osso alveolare dopo l’estrazione di un dente è dovuta principalmente alla riduzione del flusso sanguigno conseguente alla perdita del dente.
Nell’osso alveolare, il legamento parodontale, noto come desmodonto, contiene la maggior parte dell’apporto di sangue. Una volta estratto il dente e rimosso il legamento dentale circostante, si verifica una rapida e radicale perdita ossea intorno ai denti mancanti, in particolare sulle sottili pareti dell’osso orale.
L’FRP può essere utilizzato come biomateriale a innesto singolo riempiendo l’alveolo dentale con membrane a-PRF.
L’FRP può essere utilizzato in combinazione con tutti i tipi di riempitivi per innesti ossei per limitare i cambiamenti tridimensionali post-estrattivi.
Il protocollo che è diventato lo standard è stato descritto dal Dr. Joseph Choukroun come una miscela di osso conservato e i-PRF. Una copertura di membrane a-PRF completa la confezione.
Ma tutte le ricostruzioni possono essere eseguite utilizzando qualsiasi tipo di innesto osseo e la maggior parte dei biomateriali: dai sostituti ossei sintetici agli autoinnesti.
Tuttavia, i campioni prelevati dal mento, dalla parte parietale del cranio o dall’osso iliaco sono troppo complessi. Sono preferibili materiali di riempimento di origine sintetica o animale o provenienti da banche di ossa.
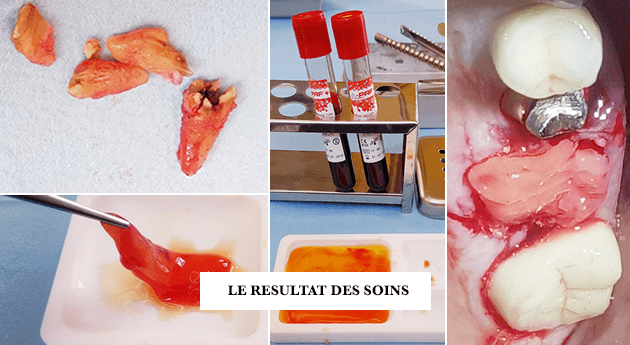

2. L’USO DEL PRF NEL SOLLEVAMENTO DEL PAVIMENTO DEL SENO MASCELLARE
NEI CASI DI ATROFIA DEL MASCELLARE POSTERIORE
Abbiamo più di trent’anni di esperienza dal primo intervento di rialzo del pavimento del seno mascellare, noto anche come rialzo del seno o riempimento del seno.
Tuttavia, i rischi sono ancora molti. Ma i protocolli innovativi che prevedono la PRF sono in grado di ottimizzare e accelerare la guarigione. In particolare, per i pazienti anziani o indeboliti da patologie che ne riducono la vascolarizzazione e quindi la capacità di guarigione. Anche un diabete equilibrato riduce la concentrazione vascolare e il flusso sanguigno addensando il sangue. Livelli elevati di colesterolo riducono la capacità delle cellule osteoblastiche di produrre osso. Gli anziani sono naturalmente il nostro gruppo principale di pazienti, poiché l’edentulismo e il riassorbimento osseo aumentano con l’età. Tuttavia, questi pazienti hanno una capacità di rigenerazione dei tessuti in diminuzione. L’uso di FRP in queste situazioni è una garanzia di miglioramento della guarigione, anche se l’ideale non esiste.
Sebbene siano stati apportati molti miglioramenti in termini di tecniche chirurgiche e scelta del biomateriale, questa procedura è ancora associata a molti rischi potenziali di complicazioni. La più comune è una lacerazione della membrana di Schneider, che riveste le pareti dei seni paranasali. È questa sottile membrana, che ha la consistenza di un “foglio di carta igienica bagnato”, che deve essere delicatamente sollevata per inserire un innesto osseo tra essa e il pavimento osseo del seno, creando così un rialzo del seno.
I dentisti che conoscono le caratteristiche anatomiche e le anomalie della cavità del seno mascellare possono perforare questa fragile membrana. L’alta percentuale di perforazione della membrana di Schneider durante un rialzo del seno mascellare può comportare un rischio di infezione acuta o cronica, come la sinusite cronica o una superinfezione infettiva o infiammatoria come la rinite. L’uso di membrane a-PRF per riparare piccole rotture di questa membrana di Schneider si è dimostrato particolarmente efficace.
La cavità intrasinusale delimitata dal pavimento del seno mascellare e dalla membrana di Schneider viene riempita dall’innesto osseo saturato con PRF in tutte le sue forme. Il contributo delle piastrine del sangue e delle cellule cicatriziali è notevole.
Nelle tecniche di innesto osseo chirurgico, come il rialzo del seno mascellare, che prevedono l’uso di PRF, il dott. Joseph Choukroun suggerisce di utilizzare S-PRF come agente legante per i granuli ossei allograft utilizzati come innesti ossei intrasinusali. L’S-PRF (PRF liquido la cui aggregazione è stata rallentata senza anticoagulante), eventualmente combinato con l’A-PRF (PRF sotto forma di membrana di fibrina), formerà infine una matrice di fibrina intorno ai granuli di biomateriale. È possibile aggiungere I-PRF per fornire più macrofagi, leucociti e cellule staminali.
Una gamma di biomateriali ossei viene utilizzata per eseguire sollevamenti unilaterali o bilaterali del seno mascellare. Questo tipo di innesto osseo viene utilizzato per gestire l’atrofia delle creste alveolari del mascellare posteriore. Gli innesti ossei utilizzati sono gli stessi impiegati per la ricostruzione ossea o per l’innesto osseo in seguito a estrazioni dentarie. Alcuni esempi sono: biomateriali di riempimento della famiglia dei sostituti ossei sintetici, biomateriali di origine animale come gli xenotrapianti, biomateriali di origine umana da donatori viventi come gli allotrapianti, biomateriali dal paziente-donatore come gli autotrapianti, con prelievo dal mento o dalla gonia o dall’angolo parietale cranico o dall’anca a livello dell’osso iliaco.
È degno di nota il fatto che le membrane di collagene siano più spesso utilizzate come barriera per le cellule gengivali e per il confezionamento di innesti ossei.
Lo sviluppo di concentrati piastrinici PRF di seconda generazione sta generando nuovi protocolli. Sono stati condotti studi iniziali per determinare se l’FRP potesse essere utilizzato da solo?
Dopo dieci anni di studi clinici, gli studi dimostrano che l’FRP può essere utilizzato da solo come materiale da innesto, ma che il più delle volte deve essere combinato con particelle di innesto osseo per migliorare il mantenimento dello spazio e il potenziale angiogenico nella tasca chirurgica formatasi nel seno mascellare tra la membrana di Schneider e il pavimento del seno.
È possibile eseguire due livelli di esame:
- Oppure un esame radiografico 2D convenzionale presso lo studio dentistico, come una panoramica dentale.
- Oppure esami radiologici eseguiti da un professionista specializzato in tomodensitometria e scansione dentale. Come il Cone Beam, che è il miglior esame 3D con meno radiazioni rispetto alla TAC.
L’esplorazione della massa ossea facciale e mascellare con l’ausilio di uno scanner tridimensionale ci permette di studiare in modo molto dettagliato i mascellari superiori e inferiori, nonché l’intera cavità orale, al fine di individuare eventuali anomalie o peculiarità anatomiche.
Nel caso del rialzo dei seni paranasali, sono interessate solo alcune strutture anatomiche: la parte posteriore della mascella, le cavità nasali contenenti i turbinati medi e i seni facciali. Le cavità sinusali sono tutte interconnesse e comprendono i seni mascellari, il seno etmoide, il seno sfenoide e il seno dell’osso frontale.
Una conca media molto grande può ostruire la narice. Ma anche se può interferire con la respirazione, finché non c’è un’ostruzione delle vie aeree sinusali, non è importante per un rialzo sinusale, proprio come i comuni polipi.
D’altra parte, un’immagine patologica come un’opacità radiologica, segno di una lesione infettiva come la sinusite mascellare, che può essere unilaterale o bilaterale, è un ostacolo all’elevazione del seno. La sinusite infettiva acuta è una controindicazione al rialzo del seno, a meno che l’intervento non risolva sia l’eziologia della sinusite acuta sia il rialzo del seno. La sinusite infiammatoria cronica non è necessariamente una controindicazione al rialzo del seno mascellare, ma deve essere considerata congiuntamente dall’otorinolaringoiatra e dal chirurgo dentale.
Il radiologo svolge un ruolo fondamentale nella diagnosi di eventuali lesioni tumorali, ostruzione ostiale, sinusite o poliposi.
La malattia parodontale colpisce le gengive e l’osso alveolare. Nello stadio finale della parodontite, il riassorbimento osseo è tale che i molari e i denti adiacenti sono completamente allentati e l’estrazione dei denti è inevitabile. Questo argomento è trattato nel capitolo sulla parodontologia.
Una volta che l’osso alveolare è stato privato dei denti che dovrebbe contenere, l’osso mascellare continua a riassorbirsi fino a diventare un sottile strato di osso di uno o due millimetri. In questo caso, la perdita ossea è tale che il volume osseo è insufficiente per gli impianti dentali.
La soluzione consiste nell’aumentare il volume osseo utilizzando uno speciale innesto osseo chiamato rialzo del pavimento mascellare. Deve essere eseguita all’interno del seno mascellare utilizzando un biomateriale vivo e vascolarizzato in grado di ricevere e osteointegrare un impianto dentale.
In alternativa, esiste l’alternativa degli impianti zigomatici.
Esistono diverse tecniche chirurgiche:
- Tecnica Summers o approccio crestale : è la tecnica meno invasiva, ma viene eseguita alla cieca ed è la meno efficace.
- La tecnica Caldwell-Luc o approccio laterale: è la più invasiva ma la più comoda e consiste nell’attraversare la parete laterale della mascella per raggiungere il seno.
L’intervento si svolge in più fasi : in anestesia generale o locale, si pratica un’incisione, si rimuove un lembo, si inserisce un innesto per ricostruire l’osso e aumentare il volume delle pareti del seno e infine si applicano le suture.
Una miscela di osso di banca, I-PRF e alcune membrane di S-PRF e A_PRF dà origine a un biomateriale bioattivo carico di fattori di crescita, chiamato “osso appiccicoso” per la sua plasticità.
Le membrane di fibrina A-PRF sono state utilizzate anche per chiudere la finestra di approccio laterale di Calwell-Luc dopo aver sollevato il pavimento del seno mascellare.
Le membrane di fibrina A-PRF sono spesso utilizzate per riparare le perforazioni della membrana di Schneider che riveste le pareti dei seni paranasali.
La perforazione per un impianto dentale o per più impianti in titanio può essere eseguita contemporaneamente al rialzo del pavimento del seno mascellare.
Una protesi dentale, come un ponte supportato da un impianto, verrà quindi posizionata subito dopo l’adattamento.
Nel post-operatorio verranno prescritti antidolorifici, profilassi antibiotica, antinfiammatori, collutori e spazzolature che evitino la zona operata.
Gli effetti post-operatori possono includere ematomi e/o emorragie.
Il rischio maggiore nell’intervento di rialzo del seno mascellare è la perforazione accidentale della membrana di Schneider. In questo caso, si può osservare una semplice infiammazione dell’area, eventualmente accompagnata da rinite.
In alternativa, può insorgere una superinfezione che compromette la guarigione dell’osso. In alcuni casi acuti, è necessario rimuovere l’innesto e pulire il seno mascellare.
Talvolta un pezzo dell’innesto può staccarsi dal corpo dell’innesto e rimanere libero nel seno. In questo caso, ci sono diversi scenari da considerare:
- Oppure è totalmente neutro e rimane nel seno;
- Oppure si evacua attraverso le vie respiratorie;
- O rimane bloccato nell’ostio non uditivo e deve essere rimosso per via endoscopica;
- Se il pezzo è troppo grande per emergere e sta causando una sinusite cronica, verrà rimosso per via endoscopica mediante una meatotomia media.
L’uso di FRP mescolato all’innesto biomateriale riduce il periodo post-operatorio e, in una certa misura, previene le complicazioni:
- L’FRP conferisce all’innesto una maggiore capacità di guarigione rispetto a un semplice biomateriale neutro. Il periodo post-operatorio è semplificato e ridotto.
- Il PRF conferisce all’innesto osseo intrasinusale una consistenza gelatinosa che impedisce il fenomeno del “bead bag”, con la fuoriuscita di granuli di biomateriale nel seno mascellare. Il rischio che un pezzo si stacchi è ridotto.
3. L’USO DEL PRF NEL TRATTAMENTO DELLA RECESSIONE MUCO-GENGIVALE
La nuova tecnica chirurgica per la rigenerazione dei tessuti molli (gengiva e mucosa attaccate) nota come FASTP (Fibrin Assisted Soft Tissue Promotion) offre miglioramenti significativi nella chirurgia estetica e plastica del contorno gengivale (chirurgia muco-gengivale).
I risultati di numerosi studi clinici randomizzati hanno evidenziato la sua spiccata capacità di promuovere la guarigione delle ferite dei tessuti molli. Questa proprietà viene sfruttata per accelerare la rigenerazione delle recessioni muco-gengivali.
Dopo anni di esperienza clinica con la PRF, è stato introdotto un nuovo concetto chirurgico, noto come tecnica FASTP o“Fibrin Assisted Soft Tissue Promotion“, che si traduce come “Ottimizzazione della rigenerazione dei tessuti molli indotta dalla fibrina”.
Il principio chirurgico è l’introduzione di membrane di fibrina A-PRF mediante tunnelling nella mucosa (con o senza l’aggiunta di gengiva attaccata prelevata dal palato) combinata con la trazione dei tessuti molli.
Questa trazione, ottenuta con suture complesse (materasso apicale), combinata con l’induzione della rigenerazione tissutale mediante PRF, porta a un recupero ottimale delle recessioni muco-gengivali.
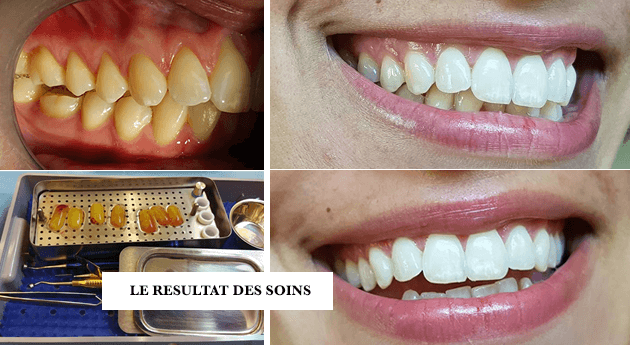


4. L’USO DEL PRF PER LA RIGENERAZIONE PARODONTALE
Negli ultimi 20 anni si è registrato un aumento della prevalenza della malattia parodontale, dovuto in particolare all’allungamento dell’aspettativa di vita.
La rigenerazione dei difetti sub-ossei e delle forcazioni delle radici dei denti è stata ottenuta utilizzando agenti biologici e fattori di crescita contenuti negli FRP.
Questi studi fanno seguito a una serie di studi pionieristici condotti utilizzando membrane barriera in collagene, che hanno stabilito per la prima volta il concetto di rigenerazione tissutale guidata (GTR) con o senza vari biomateriali per innesti ossei.
I fattori di crescita e gli agenti biologici sono stati quindi introdotti come potenziali agenti rigenerativi per i difetti peri-radicolari e sub-ossei della forcazione.
Circa 20 anni dopo l’introduzione nell’arsenale terapeutico di fattori di crescita derivati da concentrati piastrinici di prima generazione come GWPPDGF o derivati della matrice dello smalto (EMD), ora sono i concentrati piastrinici di seconda generazione, come il plasma ricco di fibrina (FRP), a essere studiati per la rigenerazione dei tessuti nei riassorbimenti parodontali.
L’FRP è stato recentemente utilizzato nel trattamento della parodontite. Le membrane di fibrina A-PRF contengono fattori di crescita autologhi in concentrazioni sovra-fisiologiche. La forma membranosa è facile da inserire nelle lesioni ossee angolari.
È stato inoltre dimostrato che la rete di fibrina agisce come una matrice temporanea che permette di creare spazio, favorendo l’angiogenesi e la formazione di coaguli di sangue nelle tasche parodontali.
Gli studi clinici randomizzati sull’uso di FRP per la rigenerazione e la riparazione dei difetti infraossei e delle forcazioni sono conclusivi.
Studi comparativi dimostrano che questa modalità di rigenerazione riduce la profondità delle tasche parodontali e aumenta il livello di attaccamento clinico della gengiva quando viene utilizzata da sola o in combinazione con altri biomateriali parodontali.
5. L’USO DEL PRF NELL’INSERIMENTO DI IMPIANTI DENTALI
L’uso di FRP favorisce l’angiogenesi e la guarigione dei tessuti intorno agli impianti
.
Gli FRP hanno un effetto benefico sulla guarigione dell’osso durante l’osteointegrazione degli impianti, oltre a migliorare i tessuti molli che li circondano.
I protocolli di trattamento sono accelerati. Il sostegno a lungo termine è ottimizzato grazie alla migliore qualità dei tessuti duri e molli.
Gli impianti dentali stanno gradualmente diventando la norma per sostituire i denti mancanti. Oggi, nonostante i possibili rischi, l’osteointegrazione dell’impianto non è più considerata una probabilità ma una certezza virtuale.
L’attenzione dei professionisti si concentra ora sulla velocità e sulla qualità dell’osteointegrazione. Le tecniche chirurgiche mirano a migliorare la qualità dell’osso per ottimizzare la stabilità primaria al momento dell’inserimento dell’impianto.
Di conseguenza, il tempo necessario per caricare l’impianto è stato ridotto: carico precoce a 6 settimane o carico immediato.
Le terapie chirurgiche sono state quindi ottimizzate, come la stabilità estetica a lungo termine, che dipende in particolare dal biotipo parodontale, cioè dalla qualità della gengiva e dalla quantità e qualità dell’osso che supporta l’impianto dentale.
La gestione del tessuto gengivale che circonda l’impianto dentale e il suo restauro è una sfida importante. È ormai riconosciuto che la vascolarizzazione dell’osso e del tessuto gengivale che circonda l’impianto dentale è essenziale per la stabilità a lungo termine. Le tendenze passate e attuali si sono concentrate sull’osso e sull’aumento dell’osso come chiave del successo implantare.
Per questo motivo, è essenziale garantire che i siti implantari siano gestiti in modo appropriato per ottimizzare il tessuto osseo e gengivale.
Il contributo del PRF e del PRP è fondamentale per questo approccio, poiché i concentrati di sangue piastrinico promuovono in modo significativo l’angiogenesi, cioè la proliferazione dei vasi sanguigni nei tessuti in cui vengono inseriti. L’aggiunta di PRP o PRF al tessuto gengivale e osseo induce una nuova vascolarizzazione e aumenta la qualità e la vitalità di questi cosiddetti tessuti “molli” e “duri”.
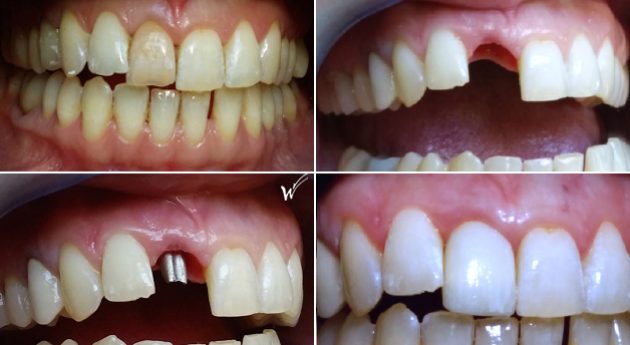
6. L’USO DEL PRF NELLA RIGENERAZIONE OSSEA GUIDATA (GBR)
La rigenerazione ossea guidata ha svolto un ruolo di primo piano nell’odontoiatria rigenerativa a partire dalla metà degli anni ’80.
Il principio della Rigenerazione Ossea Guidata ROG (cioè GBR) si basa sull’uso di membrane barriera di collagene che impediscono l’infiltrazione del tessuto osseo da parte del tessuto gengivale, la cui crescita rapida compete con il tessuto osseo mineralizzato a crescita più lenta.
Questi concetti sono ampiamente utilizzati nella ricostruzione ossea in chirurgia orale pre-implantare.
Le proteine morfogenetiche ossee (BMP) sono considerate il punto di riferimento per facilitare la formazione di nuovo osso. In particolare, la BMP 2. Tuttavia, un’ondata di ricerche che utilizzano concentrati piastrinici autologhi (PRP e PRF) ha dimostrato l’ottimizzazione dell’angiogenesi post-chirurgica con
L’uso di PRP liquido, a causa dell’incorporazione di anticoagulanti, è discutibile in caso di ROG, poiché la presenza del coagulo di fibrina è predominante.
La seconda generazione di concentrato piastrinico autologo (PRF) è stata utilizzata in odontoiatria, grazie ai suoi protocolli di preparazione sotto forma di membrana di fibrina. La PRF è stata sviluppata come membrana di nuova generazione per le procedure ROG.
L’osteoconduzione e la biocompatibilità degli innesti ossei e delle membrane barriera assorbibili (o non assorbibili) sono state ampiamente dibattute in letteratura. I biomateriali come gli innesti ossei non sono più utilizzati come materiali passivi: mescolati con gli FRP, hanno l’ulteriore vantaggio di essere attivati dalle cellule ematiche cicatriziali e dai fattori di crescita del paziente stesso. Sfruttando gli elementi del sangue che inducono la formazione dell’osso, i biomateriali sono diventati bioattivi.
7. CARICO IMMEDIATO DI UNA PROTESI COMPLETA CON PRF
La riabilitazione dentale di pazienti con denti completamente edentuli rimane una sfida importante per il professionista.
Si stima che oltre il 20% della popolazione di età superiore ai 65 anni soffra di perdita completa dei denti. Con l’invecchiamento della popolazione, questo numero continuerà a crescere.
Nel protocollo del Dr. Alain Simonpieri, la stabilità primaria degli impianti dentali nell’osso nativo viene ottimizzata con l’inserimento di una protesi immediata (arcata dentale completa avvitata). Riduce i micromovimenti a meno di 200 micron. È la base della tecnologia.
Le tecniche di chirurgia implantare che prevedono il carico immediato dopo l’inserimento degli impianti dentali aumentano il loro tasso di sopravvivenza e migliorano l’estetica gengivale grazie all’immobilizzazione molto precoce degli impianti.
L’obiettivo è mantenere la stabilità a lungo termine degli impianti e l’estetica della protesi. L’uso della fibrina autologa ricca di piastrine (PRF) nelle sue forme a membrana (A-PRF) e iniettabile (I-PRF) come agenti biologici in grado di indurre una vascolarizzazione precoce dell’osso e dei tessuti molli ottimizza questo obiettivo. In altre parole, il contributo di a-PRF e i-PRF a questa tecnica chirurgica ottimizza l’obiettivo principale, che è quello di ottimizzare l’osteointegrazione e la stabilità a lungo termine dei tessuti duri e molli intorno agli impianti per preservare l’estetica.

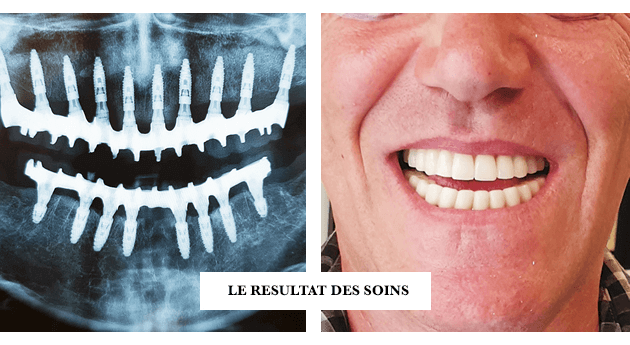

8 . L’USO DEL PRF NEL RINGIOVANIMENTO E NELL’ESTETICA DEL VISO
Losviluppo di protocolli di centrifugazione a velocità inferiori rispetto al PRP ha portato allo sviluppo dell’I-PRF, un plasma liquido ricco di fibrina che può essere iniettato nei tessuti molli.
Può essere utilizzato come sostituto autologo delle terapie PRP convenzionali. A differenza di quest’ultimo, ha il vantaggio di non contenere additivi o anti-coagulanti noti per inibire la rigenerazione dei tessuti.
Le iniezioni di I-PRF nel derma o nel tessuto connettivo del viso sono innegabilmente un protocollo importante nelle terapie di ringiovanimento della pelle.
Inoltre, queste iniezioni intorno o dentro le cicatrici sono particolarmente efficaci per ridurre le cicatrici cheloidi o quelle da acne.
Un numero crescente di dentisti si sta formando in estetica facciale. Con l’avanzare dell’età, la popolazione si preoccupa sempre più del proprio aspetto estetico. Per le procedure di ringiovanimento del viso si è fatto sempre più ricorso a prodotti come il botox, gli acidi ialuronici, i fili PDO e il plasma ricco di piastrine (PRP), tra gli altri.
Si stima che ogni anno negli Stati Uniti vengano eseguiti oltre 16 milioni di interventi estetici e questa tendenza è destinata ad aumentare con l’invecchiamento della popolazione. Le tecniche sono più pratiche, più economiche e più sicure.
9. USO DEL PLASMA DI FIBRINA RICCO IN MEDICINA
La fibrina ricca di plasma (PRF) è ampiamente utilizzata in chirurgia odontoiatrica, ma viene applicata molto più frequentemente in medicina generale per diverse indicazioni.
– La PRF è stata utilizzata per la prima volta per trattare le ulcere dolorose delle gambe. È stato inoltre dimostrato che migliorano una serie di ulcere alle gambe e alle mani;
– La PRF viene utilizzata in chirurgia plastica e medicina estetica per trattare i difetti dei tessuti molli del viso, le riotidi superficiali (rughe), le cicatrici da acne e le procedure chirurgiche di lipostruttura;
– La PRF viene utilizzata in otorinolaringoiatria per guarire le perforazioni traumatiche acute del tamburo auricolare;
– La PRF viene utilizzata in ortopedia e reumatologia per il trattamento di lesioni tendinee, osteoartrite del ginocchio e strappi cronici della cuffia dei rotatori in reumatologia;
– La PRF viene utilizzata in chirurgia generale per la gestione della colecistectomia laparoscopica, la riparazione del prolasso vaginale e la riparazione della fistola uretro-cutanea;
Queste sono solo alcune delle numerose indicazioni dell’FRP per la rigenerazione estensiva in vari campi della medicina al di fuori del settore dentale.
Ogni giorno vengono scoperte nuove applicazioni. La storia della medicina e dell’odontoiatria rigenerativa è appena iniziata.

SEI UNICO!
APPLICAZIONI CLINICHE DELL'ODONTOIATRIA RIGENERATIVA RIGENERAZIONE DEI TESSUTI E PRF
SITUAZIONE INIZIALE VS. SITUAZIONE DI PARTENZA. ESITO CLINICO
QUALI SONO I COMPONENTI BIOLOGICI DELLA PRF (FIBRINA RICCA DI PIASTRINE)?
I componenti biologici della PRF (Platelet Rich Fibrin): I fattori di crescita e la loro azione sull’attività cellulare.
Durante il processo di guarigione naturale, il sangue svolge un ruolo centrale nella rigenerazione dei tessuti, fornendo vari tipi di cellule del sangue, fattori di crescita, citochine e fattori di coagulazione.
Il concetto di PRP, come quello di PRF, è l’accelerazione e il potenziamento dei processi naturali di guarigione o rigenerazione dell’organismo mediante agenti ematici naturali autologhi.
Il tutto grazie a tecniche che prevedono l’iniezione di dosi sovra-fisiologiche di piastrine contenenti i fattori molecolari che inducono la rigenerazione dei tessuti.
Il PRP (Platelet Rich Plasma) è stato inizialmente sviluppato per aumentare il numero di piastrine nei siti cicatriziali. Tuttavia, l’uso di anticoagulanti di origine animale non rende questo protocollo ottimale, anche se il recupero è giudicato quasi ottimale.
Il concentrato di seconda generazione noto come PRF (Fibrina Ricca di Piastrine) è stato quindi sviluppato come descritto sopra.
I BENEFICI DEL PRF
Primo vantaggio: è naturale al 100%, senza anticoagulanti esogeni.
Nel corso degli anni, una serie di scoperte ha portato a comprendere che la fibrina agisce sull’ancoraggio di diversi tipi di cellule, consentendo loro di rilasciare fattori di crescita in modo lento e progressivo.
È stato dimostrato che questo rilascio migliora l’angiogenesi, il comportamento delle cellule cicatrizzanti e quindi la rigenerazione dei tessuti.
Il secondo vantaggio è che ottimizza l’ingegneria tissutale
Fornisce le tre chiavi fondamentali per ottimizzare l’ingegneria tissutale:
Come il PRP, il PRF contiene molte piastrine del sangue. La preparazione del PRF modificando la velocità e il tempo di centrifugazione determina un arricchimento in elementi del gruppo delle plasmacellule curative. È stato dimostrato che la riduzione della velocità e del tempo di centrifugazione aumenta il numero di macrofagi e leucociti. Queste cellule sono importanti per la difesa dell’ospite e la guarigione delle ferite.
Queste cellule del sangue svolgono un ruolo importante nella guarigione delle ferite perché secernono molti fattori di crescita in grado di indurre la migrazione, la proliferazione e la differenziazione delle cellule. Queste piastrine e le cellule che formano cicatrici, come i leucociti, secernono un gran numero di fattori molecolari che inducono la rigenerazione e la crescita dei tessuti.
In particolare:
- Fattore di crescita trasformante-B1 (TGF-B1);
- Fattore di crescita di derivazione piastrinica (PDGF);
- Fattore di crescita dell’endotelio vascolare (VEGF);
- Insulin-like Growth Factor-1 (IGF-1), in grado di promuovere ulteriormente la migrazione, la proliferazione e la differenziazione cellulare.
Il PRF contiene il 100% dei leucociti del campione, rispetto al 10-50% dei leucociti del PRP, a seconda del materiale utilizzato.
Poiché nella preparazione del PRF non vengono utilizzati anticoagulanti, l’impalcatura tridimensionale di fibrina si forma in modo del tutto biologico e naturale. Nel corso degli anni, numerose scoperte hanno portato a comprendere che l’e
La ricerca scientifica ha permesso di capire che questo coagulo di fibrina svolge due azioni simultanee:
- Tenere prigionieri i diversi tipi di cellule del sangue necessari per la guarigione: la fibrina agisce per ancorare diversi tipi di cellule.
- I fattori di crescita vengono rilasciati gradualmente nel tempo, sia in termini di quantità che di tipologia: l’ancoraggio delle cellule alla matrice di fibrina consente a queste ultime di rilasciare i fattori di crescita in modo lento e progressivo.
È stato dimostrato che questo rilascio di fattori di crescita, di quantità e natura variabile nel tempo, induce il comportamento delle cellule, consentendo l’angiogenesi e, in ultima analisi, la rigenerazione dei tessuti.
È quindi facile capire che gli FRP aiutano l’organismo a guarire in modo più rapido ed efficace.
QUALI SONO I PROTOCOLLI DI PRODUZIONE DEL PRF E COME SI SONO EVOLUTI?
L’EVOLUZIONE DELLE TECNICHE DI PRODUZIONE DEI PRF VERSO IL CONCETTO DI CENTRIFUGAZIONE A BASSA VELOCITÀ
Negli ultimi cinque anni, ulteriori modifiche alla velocità e al tempo di centrifugazione hanno migliorato i protocolli di produzione degli FRP. Un nuovo concetto è stato definito “concetto di centrifugazione a bassa velocità”.
Riducendo la velocità di centrifugazione del sangue appena prelevato dal paziente in provette appositamente adattate, è stato possibile raccogliere una nuova serie di cellule, principalmente leucociti.
Il concetto di centrifugazione a bassa velocità (LSCC) introduce l’idea che, con una riduzione della forza di centrifugazione applicata o RCF (Relevant Centrifugation Forces), la matrice di fibrina intrappola un numero maggiore di cellule infiammatorie curative e di piastrine, che a loro volta contengono fattori di crescita.
Il PRF avanzato (A-PRP) e il PRF avanzato plus (A-PRF +) assumono la forma di matrici solide, che costituiscono la base del PRF.
L’A-PRF + preparato secondo il concetto LSCC, rispetto al PRF, presenta un numero maggiore di piastrine e leucociti. Mostra concentrazioni significativamente più elevate di rilascio di fattori di crescita nell’arco di 10 giorni.
Inoltre, un’ulteriore riduzione dell’RCF basata sul concetto di LSCC ha permesso di sviluppare un PRF iniettabile (i-PRF) senza l’uso di anticoagulanti. Speciali provette per il prelievo di sangue ritardano naturalmente l’organizzazione della matrice di fibrina, senza l’uso di anticoagulanti, in modo da poter essere utilizzate clinicamente in tempi brevi ma ragionevoli.
L’i-PRF, preparato con l’FCR più basso, contiene il maggior numero di leucociti e piastrine, illustrando l’effetto dell’LSCC su questo sistema di concentrato di sangue.
I leucociti sono i principali protagonisti del processo di guarigione e rigenerazione. La loro presenza nelle matrici Advanced PRF e Injectable-PRF evidenzia la loro migliore capacità di rigenerazione. I nuovi protocolli di produzione per le matrici A-PRF e le iniezioni I-PRF hanno un’ampia gamma di applicazioni cliniche in odontoiatria, chirurgia maxillo-facciale e altri campi medici.
Grazie al protocollo di preparazione semplificato e minimamente invasivo, l’efficacia di questo sistema è evidente.
IL PROTOCOLLO PER OTTENERE IL PRF (J.CHOUKROUN, SCHLEICHER 2000)
Come si preparano gli FRP?
Il sangue è composto per il 99% da globuli rossi, per lo 0,2% da globuli bianchi e per lo 0,6-1% da piastrine (trombociti) che servono per la coagulazione del sangue.
Un campione di sangue viene prelevato dal paziente in un massimo di 4 fiale da 10 ml (una quantità ridotta rispetto al volume totale di sangue ed equivalente a un esame del sangue convenzionale).
La centrifugazione delle fiale di sangue separa i suoi componenti e recupera un concentrato ricco di piastrine.
Una parte viene utilizzata per preparare una sottile membrana di circa 1 mm di spessore che viene utilizzata per coprire i siti chirurgici.
Un’altra parte può essere mescolata con l’osso autogeno, allogeno, xenogenico o alloplastico (sintetico) utilizzato per riempire il difetto osseo.
Usi clinici: Otturazioni sinusali, con possibilità di inserimento immediato dell’impianto a seconda dei casi, riempimento di deficit ossei dopo l’estrazione, guarigione dei tessuti molli dopo l’inserimento dell’impianto.
Conclusioni: Grazie al lavoro dell’ingegneria genetica degli ultimi 10 anni, la rigenerazione ossea avviene più velocemente, in maggiore quantità e qualità e con un margine più sicuro rispetto ad altri metodi.
Le tecniche chirurgiche utilizzate sono ottimizzate dall’uso di concentrato piastrinico autologo.
Il PRP o Plasma Ricco di Piastrine è un sistema distribuito dall’azienda REGENLAB convalidato dal Professor Meningaud (Henry Mondor Hospital).
PRF o Platelet Rich Fibrin è un protocollo di recupero sviluppato dal dottor J. Choukroun.
Altre tecniche di centrifugazione del sangue: Plasma ricco di fattori di crescita o P.R.G.F (Anitua 1999).




